Nội dung sản phẩm
Chúng tôi mong muốn hiển thị cho bạn thông tin sản phẩm chính xác. Nội dung, các nhà sản xuất và những gì cung cấp bạn thấy ở đây và chúng tôi chưa xác minh điều đó. Từ chối trách nhiệm
Thành phần
Mỗi viên Dung dịch tiêm chứa:
| Thông tin thành phần | Hàm lượng |
|---|---|
| Liraglutide | 6mg/ml |
Công dụng (Chỉ định)
VICTOZA® được chỉ định sử dụng:
- Kết hợp với chế độ ăn uống và luyện tập thể dục để cải thiện kiểm soát đường huyết ở người lớn và trẻ em từ 10 tuổi trở lên mắc đái tháo đường type 2.
- Giảm nguy cơ các biến cố tim mạch nghiêm trọng (tử vong do tim mạch, nhồi máu cơ tim không tử vong hoặc đột quỵ không tử vong) ở người lớn mắc đái tháo đường type 2 và có bệnh tim mạch đã được xác định.
Hạn chế sử dụng:
- VICTOZA® không nên được sử dụng cho bệnh nhân mắc đái tháo đường type 1.
- VICTOZA® chứa liraglutide và không nên dùng đồng thời với các sản phẩm khác cũng chứa liraglutide.
Cách dùng & Liều dùng
Cách dùng
-
Kiểm tra dung dịch bằng mắt trước mỗi lần tiêm. Chỉ sử dụng khi dung dịch trong suốt, không màu và không có hạt lạ.
-
Tiêm dưới da VICTOZA® mỗi ngày một lần vào bất kỳ thời điểm nào trong ngày, không phụ thuộc vào bữa ăn.
-
Tiêm ở vùng bụng, đùi hoặc cánh tay trên. Không cần điều chỉnh liều khi thay đổi vị trí hoặc thời gian tiêm.
-
Luân phiên vị trí tiêm trong cùng một vùng để giảm nguy cơ loạn dưỡng da dạng tinh bột [xem phần Tác dụng không mong muốn (6.2)].
-
Nếu sử dụng VICTOZA® cùng insulin:
-
Tiêm riêng biệt, không pha trộn.
-
Có thể tiêm cùng một vùng cơ thể nhưng không nên tiêm cạnh nhau.
-
Liều dùng
Bệnh nhân người lớn
-
Liều khởi đầu khuyến cáo của VICTOZA® là 0,6 mg tiêm dưới da mỗi ngày một lần trong 1 tuần.
Lưu ý: Liều 0,6 mg mỗi ngày nhằm giảm các triệu chứng tiêu hóa trong giai đoạn khởi đầu điều trị và không có hiệu quả kiểm soát đường huyết ở người lớn.
-
Sau 1 tuần sử dụng liều 0,6 mg mỗi ngày, tăng liều lên 1,2 mg tiêm dưới da mỗi ngày một lần.
-
Nếu cần kiểm soát đường huyết tốt hơn, tăng liều lên mức tối đa được khuyến cáo là 1,8 mg tiêm dưới da mỗi ngày một lần, sau ít nhất 1 tuần điều trị với liều 1,2 mg.
Bệnh nhân nhi từ 10 tuổi trở lên
-
Liều khởi đầu khuyến cáo là 0,6 mg tiêm dưới da mỗi ngày một lần.
-
Nếu cần kiểm soát đường huyết tốt hơn, có thể tăng liều từng bước 0,6 mg, mỗi lần tăng sau ít nhất 1 tuần sử dụng liều trước đó.
-
Liều tối đa được khuyến cáo là 1,8 mg tiêm dưới da mỗi ngày một lần.
Khuyến cáo khi bỏ lỡ liều
-
Hướng dẫn bệnh nhân tiếp tục sử dụng liều hàng ngày như bình thường với liều kế tiếp nếu bỏ lỡ một liều. Không tiêm gấp đôi liều hoặc tăng liều để bù lại liều đã quên.
-
Nếu bỏ lỡ liều hơn 3 ngày, hãy bắt đầu lại điều trị với liều 0,6 mg mỗi ngày để giảm tác dụng phụ về tiêu hóa khi khởi đầu lại. Sau đó, tăng liều dần theo hướng dẫn của nhân viên y tế.
Quá liều
Các trường hợp quá liều đã được báo cáo trong các thử nghiệm lâm sàng và trong quá trình sử dụng VICTOZA® sau khi đưa ra thị trường.
Các tác dụng quan sát được bao gồm:
-
Buồn nôn nghiêm trọng,
-
Nôn mửa nghiêm trọng,
-
và hạ đường huyết nghiêm trọng.
Trong trường hợp quá liều, cần bắt đầu điều trị hỗ trợ thích hợp dựa trên dấu hiệu lâm sàng và triệu chứng của bệnh nhân.
Chống chỉ định
VICTOZA® chống chỉ định sử dụng cho:
-
Bệnh nhân có tiền sử cá nhân hoặc gia đình bị ung thư tuyến giáp thể tủy (medullary thyroid carcinoma – MTC), hoặc bệnh nhân mắc hội chứng u nội tiết đa tuyến type 2 (Multiple Endocrine Neoplasia type 2 – MEN 2).
-
Bệnh nhân có phản ứng quá mẫn nghiêm trọng với liraglutide hoặc bất kỳ tá dược nào có trong VICTOZA®.
Tác dụng phụ
Tác dụng phụ nghiêm trọng của Victoza®
Các phản ứng bất lợi nghiêm trọng có thể xảy ra khi sử dụng Victoza® gồm:
- Nguy cơ ung thư tuyến giáp thể C
- Viêm tụy
- Hạ đường huyết
- Tổn thương thận cấp
- Phản ứng dị ứng
- Bệnh túi mật cấp
- Nguy cơ sặc phổi khi gây mê toàn thân hoặc an thần sâu
(Chi tiết xem phần “Cảnh báo và thận trọng” trong hướng dẫn sử dụng.)
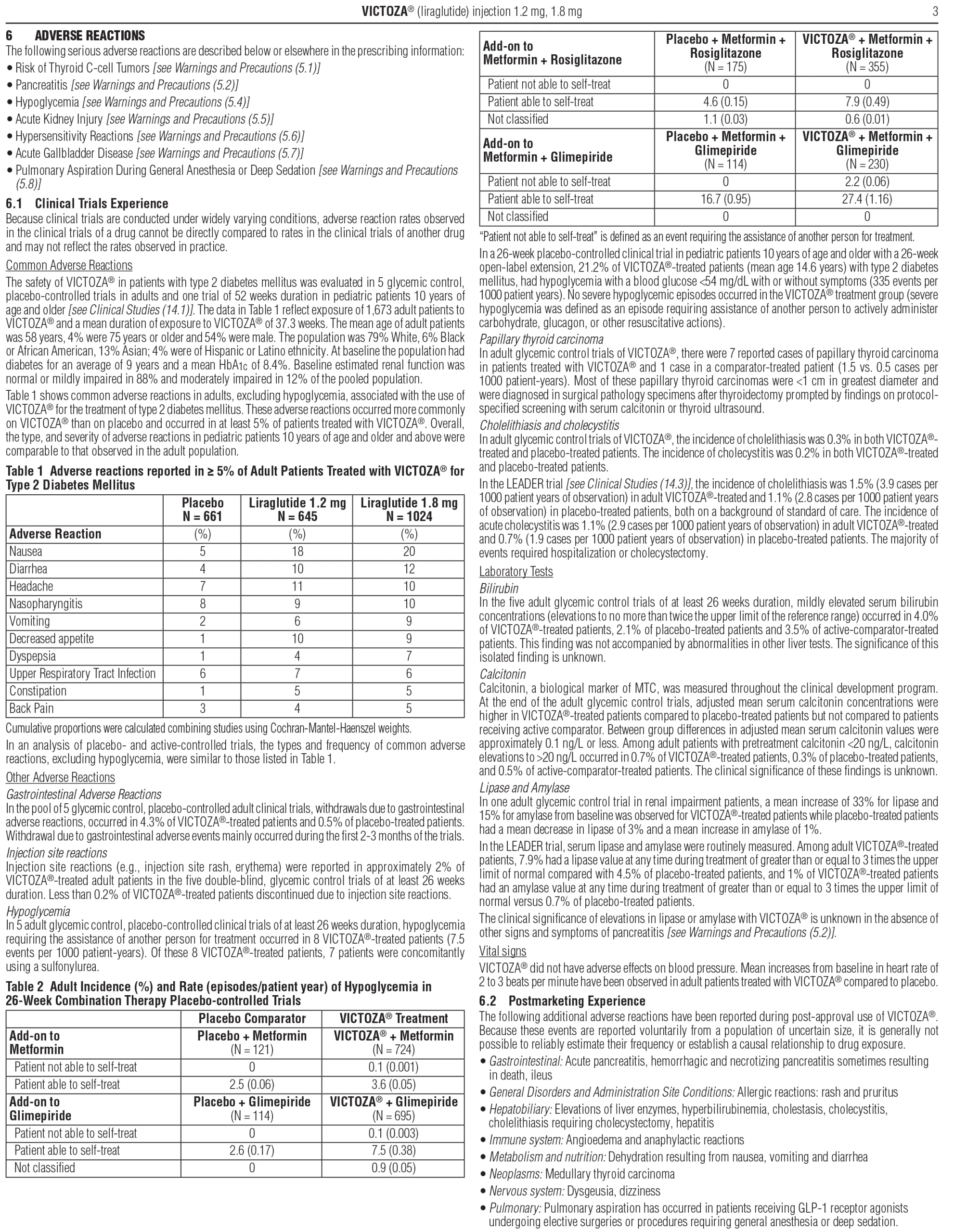
Tác dụng phụ phổ biến (≥5%) ở người lớn trong các nghiên cứu lâm sàng
| Tác dụng phụ | Placebo | Victoza 1.2 mg | Victoza 1.8 mg |
|---|---|---|---|
| Buồn nôn | 5% | 18% | 20% |
| Tiêu chảy | 4% | 10% | 12% |
| Đau đầu | 7% | 11% | 10% |
| Viêm mũi họng | 8% | 9% | 10% |
| Nôn | 2% | 6% | 9% |
| Chán ăn | 1% | 10% | 9% |
| Khó tiêu | 1% | 4% | 7% |
| Viêm đường hô hấp trên | 6% | 7% | 6% |
| Táo bón | 1% | 5% | 5% |
| Đau lưng | 3% | 4% | 5% |
Tác dụng phụ ở trẻ từ 10 tuổi trở lên tương tự người lớn.
Tác dụng phụ khác được ghi nhận
- Rối loạn tiêu hóa là nguyên nhân khiến 4.3% bệnh nhân ngưng dùng thuốc (chủ yếu xảy ra trong 2–3 tháng đầu).
- Phản ứng tại chỗ tiêm như nổi mẩn, đỏ da xảy ra ở 2% bệnh nhân, nhưng ít người phải ngưng thuốc (<0.2%).
- Hạ đường huyết nghiêm trọng (cần người khác hỗ trợ) thường xảy ra ở bệnh nhân dùng chung với sulfonylurea.
Ví dụ hạ đường huyết khi phối hợp điều trị (Victoza® + các thuốc khác):
- Victoza + Metformin: 3.6% (tự xử lý), 0.1% (không thể tự xử lý)
- Victoza + Glimepiride: 27.4% (tự xử lý), 2.2% (không thể tự xử lý)
Tác dụng phụ ít gặp nhưng cần lưu ý
- Ung thư tuyến giáp dạng nhú: 7 ca trên Victoza®, 1 ca trên thuốc so sánh (1.5 vs 0.5 ca/1000 bệnh nhân-năm)
- Sỏi mật (cholelithiasis): ~0.3% (cả nhóm Victoza® và placebo)
- Viêm túi mật cấp (cholecystitis): ~0.2–1.1%, một số ca phải nhập viện hoặc phẫu thuật
- Tăng nhẹ bilirubin (4% bệnh nhân), không kèm bất thường gan khác
- Tăng nhẹ calcitonin (0.7% có giá trị >20 ng/L), ý nghĩa lâm sàng chưa rõ
- Tăng men tụy (lipase, amylase): Ghi nhận tăng 33% lipase và 15% amylase; khoảng 7.9% có tăng lipase ≥3 lần giới hạn bình thường
Tương tác thuốc
Ảnh hưởng của việc làm chậm làm rỗng dạ dày đến thuốc uống
- VICTOZA® gây ra tình trạng làm chậm quá trình làm rỗng dạ dày, do đó có thể ảnh hưởng đến sự hấp thu của các thuốc uống dùng cùng lúc.
- Tuy nhiên, trong các nghiên cứu dược lý lâm sàng, VICTOZA® không làm ảnh hưởng đáng kể đến sự hấp thu của các loại thuốc uống đã được thử nghiệm [xem phần Dược lý lâm sàng.
- Mặc dù vậy, cần thận trọng khi dùng đồng thời VICTOZA® với các thuốc uống khác.
Sử dụng đồng thời với thuốc kích thích tiết insulin (ví dụ: Sulfonylurea) hoặc với insulin
- VICTOZA® kích thích tuyến tụy tiết insulin khi nồng độ đường huyết tăng cao.
- Khi dùng VICTOZA® kết hợp với thuốc kích thích tiết insulin (như sulfonylurea) hoặc insulin, người bệnh có nguy cơ hạ đường huyết cao hơn, bao gồm cả các trường hợp hạ đường huyết nghiêm trọng.
- Khi bắt đầu sử dụng VICTOZA®, nên cân nhắc giảm liều các thuốc sulfonylurea hoặc insulin đang dùng để giảm nguy cơ hạ đường huyết
Lưu ý (Thận trọng khi sử dụng)
Thận trọng khi sử dụng
Nguy cơ ung thư tế bào C tuyến giáp
-
Liraglutide (hoạt chất của VICTOZA®) gây ra u tuyến giáp phụ thuộc liều và thời gian điều trị ở chuột, bao gồm cả ung thư tuyến giáp thể tủy (MTC).
-
Chưa xác định được liệu VICTOZA® có gây ung thư tuyến giáp ở người hay không.
-
Chống chỉ định với người có tiền sử cá nhân hoặc gia đình bị MTC, hoặc hội chứng MEN 2.
-
Cần tư vấn cho bệnh nhân về các triệu chứng của ung thư tuyến giáp: có khối ở cổ, khó nuốt, khó thở, khàn tiếng kéo dài.
-
Việc theo dõi calcitonin huyết thanh hay siêu âm tuyến giáp định kỳ không được khuyến cáo do độ đặc hiệu thấp và có thể gây làm thêm xét nghiệm không cần thiết.
Viêm tụy cấp
-
Đã có báo cáo về viêm tụy cấp, kể cả thể hoại tử và tử vong, ở bệnh nhân dùng VICTOZA®.
-
Cần ngưng thuốc ngay lập tức nếu nghi ngờ viêm tụy (đau bụng dữ dội, lan ra sau lưng, có/không kèm nôn).
-
Không sử dụng lại nếu đã xác định viêm tụy.
-
Tỷ lệ viêm tụy ở bệnh nhân dùng VICTOZA®: 2.7/1000 bệnh nhân-năm so với 0.5 ở nhóm glimepiride.
Không dùng chung bút tiêm VICTOZA®
-
Không được chia sẻ bút tiêm giữa các bệnh nhân, kể cả khi đã thay kim, do nguy cơ lây truyền các bệnh qua đường máu.
Nguy cơ hạ đường huyết
-
Khi dùng VICTOZA® cùng sulfonylurea hoặc insulin, nguy cơ hạ đường huyết tăng, bao gồm cả hạ đường huyết nặng.
-
Ở trẻ từ 10 tuổi trở lên, nguy cơ hạ đường huyết cao dù có hay không dùng insulin/metformin.
-
Cần giảm liều các thuốc sulfonylurea hoặc insulin khi kết hợp với VICTOZA®.
Suy thận cấp
-
Đã có báo cáo sau khi lưu hành về suy thận cấp hoặc làm nặng bệnh thận mạn ở bệnh nhân dùng VICTOZA®, đôi khi phải chạy thận.
-
Các trường hợp thường gặp ở người mất nước do buồn nôn, nôn, tiêu chảy.
-
Thận trọng khi khởi đầu hoặc tăng liều ở bệnh nhân suy thận.
Phản ứng quá mẫn
-
Đã có báo cáo về các phản ứng dị ứng nghiêm trọng như sốc phản vệ, phù mạch.
-
Nếu xảy ra, ngừng thuốc và xử trí kịp thời.
-
Chống chỉ định nếu từng có phản ứng dị ứng nặng với liraglutide hoặc thành phần của thuốc.
Bệnh túi mật cấp
-
Có thể gây sỏi mật hoặc viêm túi mật. Trong nghiên cứu LEADER, 3.1% bệnh nhân VICTOZA® gặp biến cố này so với 1.9% ở nhóm giả dược.
-
Nếu nghi ngờ, cần chẩn đoán và theo dõi túi mật.
Nguy cơ hít phải trong gây mê toàn thân hoặc tiền mê sâu
-
VICTOZA® làm chậm làm rỗng dạ dày, có thể khiến dịch tiêu hóa còn lại trong dạ dày, gây hít phải dịch dạ dày trong khi gây mê.
-
Cần khuyên bệnh nhân thông báo với bác sĩ nếu chuẩn bị phẫu thuật và đang dùng VICTOZA®.
Dược động học (Tác động của cơ thể với thuốc)
Hấp thu
Sau khi tiêm dưới da, nồng độ tối đa trong máu đạt được sau 8–12 giờ.
Với liều đơn 0,6 mg, Cmax trung bình là 35 ng/mL, và AUC là 960 ng·h/mL.
Khi tăng liều từ 0,6 mg đến 1,8 mg, Cmax và AUC tăng tương ứng theo liều.
Ở liều 1,8 mg/ngày, nồng độ ổn định trung bình trong 24 giờ là 128 ng/mL.
So sánh các vị trí tiêm:
- Cánh tay và bụng: AUC tương đương nhau.
- Đùi: AUC thấp hơn bụng khoảng 22%, nhưng sự khác biệt không đáng kể về tổng hấp thu.
Sinh khả dụng tuyệt đối (sau tiêm dưới da): khoảng 55%.
Phân bố
Thể tích phân bố rõ ràng sau tiêm dưới da 0,6 mg: ~13 L.
Sau tiêm tĩnh mạch: ~0,07 L/kg.
Liraglutide gắn mạnh với protein huyết tương, >98%.
Thải trừ
Độ thanh thải rõ ràng trung bình: 1,2 L/h.
Thời gian bán hủy: khoảng 13 giờ.
Chuyển hóa
Trong 24 giờ đầu sau tiêm liều [3H]-liraglutide, dạng chính trong huyết tương là liraglutide nguyên vẹn.
Liraglutide được chuyển hóa nội sinh tương tự như các protein lớn khác, không có cơ quan nào là nơi đào thải chính.
Thải trừ
Liraglutide nguyên vẹn không phát hiện trong nước tiểu hay phân.
Một phần nhỏ (6% nước tiểu, 5% phân) chứa các chất chuyển hóa liên quan đến liraglutide.
Phần lớn phóng xạ (từ thuốc đánh dấu) được bài tiết trong 6–8 ngày đầu.
Dược lực học (Tác động của thuốc lên cơ thể)
Liraglutide là một chất chủ vận thụ thể Glucagon-Like Peptide-1 (GLP-1) của người đã được acyl hóa, có độ đồng nhất chuỗi axit amin 97% với GLP-1(7-37) nội sinh của con người. GLP-1(7-37) chiếm ít hơn 20% tổng lượng GLP-1 nội sinh trong tuần hoàn. Giống như GLP-1(7-37), liraglutide kích hoạt thụ thể GLP-1, một thụ thể gắn trên màng tế bào kết hợp với cyclase adenylyl qua protein G kích thích Gs trong tế bào beta tuyến tụy. Liraglutide làm tăng nồng độ AMP vòng (cAMP) trong tế bào, dẫn đến việc tiết insulin khi nồng độ glucose trong máu cao. Quá trình tiết insulin này giảm dần khi nồng độ glucose trong máu giảm và đạt đến mức đường huyết bình thường. Liraglutide cũng giảm tiết glucagon một cách phụ thuộc vào mức glucose.
Cơ chế giảm đường huyết cũng liên quan đến sự trì hoãn quá trình làm rỗng dạ dày.
GLP-1(7-37) có thời gian bán hủy từ 1,5 đến 2 phút do bị phân hủy bởi các enzym nội sinh phổ biến, bao gồm dipeptidyl peptidase IV (DPP-IV) và neutral endopeptidases (NEP). Khác với GLP-1 tự nhiên, liraglutide ổn định hơn đối với sự phân hủy chuyển hóa bởi cả hai loại peptidase này và có thời gian bán hủy trong huyết tương là 13 giờ.
Bảo quản
- Bảo quản trong tủ lạnh (2°C – 8°C). Để xa bộ phận làm lạnh. Không để đông lạnh
- Sau khi sử dụng lần đầu: Bảo quản dưới 30°C hoặc trong tủ lạnh (2°C – 8°C).
- Không để đông lạnh. Đậy nắp bút tiêm để tránh ánh sáng.
- Hủy bỏ bút tiêm trong vòng 1 tháng sau khi sử dụng lần đầu.
Hạn dùng
30 tháng kể từ ngày sản xuất
Bài viết được cập nhật lần cuối 16 Tháng 4, 2025
Thông tin thương hiệu

Novo Nordisk
Giới thiệu về Novo Nordisk
Novo Nordisk là một trong những tập đoàn dược phẩm hàng đầu thế giới, chuyên nghiên cứu, phát triển và sản xuất các loại thuốc điều trị tiểu đường, béo phì, bệnh hiếm và các rối loạn nội tiết. Công ty có trụ sở chính tại Bagsværd, Đan Mạch và hoạt động tại hơn 80 quốc gia trên toàn cầu.
Với hơn 100 năm kinh nghiệm trong lĩnh vực chăm sóc sức khỏe, Novo Nordisk cam kết cung cấp các giải pháp y tế tiên tiến, cải thiện chất lượng cuộc sống cho hàng triệu bệnh nhân trên thế giới.
Lịch sử hình thành và phát triển
- 1923: Thành lập tại Đan Mạch, tiên phong trong nghiên cứu và sản xuất insulin.
- 1989: Sáp nhập với Nordisk Gentofte, hình thành Novo Nordisk như ngày nay.
- 2000: Ra mắt NovoRapid, một trong những loại insulin tác dụng nhanh phổ biến nhất thế giới.
- 2015: Phát triển Saxenda, thuốc hỗ trợ giảm cân dành cho bệnh nhân béo phì.
- 2021: Ra mắt Wegovy, thuốc giảm cân tiên tiến dựa trên hoạt chất semaglutide.
- Hiện nay: Tiếp tục dẫn đầu trong lĩnh vực điều trị tiểu đường, béo phì và các bệnh nội tiết hiếm gặp.
Thế mạnh của Novo Nordisk
Danh mục sản phẩm đa dạng
- Tiểu đường: Insulin (NovoRapid, Levemir, Tresiba), thuốc điều trị tiểu đường loại 2 (Ozempic, Rybelsus).
- Béo phì: Saxenda, Wegovy.
- Bệnh nội tiết hiếm gặp: Thuốc điều trị rối loạn tăng trưởng và thiếu hụt hormone.
- Huyết học: Điều trị bệnh hemophilia và rối loạn đông máu.
Công nghệ và nghiên cứu tiên tiến
- Đi đầu trong công nghệ insulin tái tổ hợp, giúp cải thiện khả năng kiểm soát đường huyết.
- Ứng dụng GLP-1 receptor agonist trong điều trị tiểu đường và béo phì.
- Đầu tư hàng tỷ USD vào nghiên cứu và phát triển mỗi năm.
Cam kết phát triển bền vững
- Mục tiêu trung hòa carbon trong sản xuất vào năm 2030.
- Chương trình Changing Diabetes hỗ trợ bệnh nhân tiểu đường tại các nước thu nhập thấp.
- Hợp tác với WHO và các tổ chức y tế để nâng cao nhận thức về bệnh tiểu đường.
Thành tựu nổi bật
- Công ty dược phẩm số 1 thế giới trong lĩnh vực điều trị tiểu đường.
- Wegovy được FDA phê duyệt là thuốc giảm cân tiên tiến nhất hiện nay.
- Nằm trong danh sách Fortune 500 công ty dược phẩm hàng đầu toàn cầu.
Thông tin liên hệ
- Trụ sở chính: Novo Allé, Bagsværd, Đan Mạch
- Website: www.novonordisk.com
- Điện thoại: +45 4444 8888
Novo Nordisk cam kết tiếp tục đổi mới, mang đến những giải pháp y tế tiên tiến và nâng cao chất lượng cuộc sống cho bệnh nhân trên toàn thế giới.



























 - Thư viện thông tin cho dược sĩ và người dùng
- Thư viện thông tin cho dược sĩ và người dùng