Nội dung sản phẩm
Chúng tôi mong muốn hiển thị cho bạn thông tin sản phẩm chính xác. Nội dung, các nhà sản xuất và những gì cung cấp bạn thấy ở đây và chúng tôi chưa xác minh điều đó. Từ chối trách nhiệm
Thành phần
Mỗi viên Viên nén bao phim chứa:
| Thông tin thành phần | Hàm lượng |
|---|---|
| Capecitabine | 500mg |
Lactose, anhydrous (Super Tab 21N), croscarmellose sodium (Ac-di-sol), hypromellose 2910 SCPS (Mehocel E5 LV Premium), microcrystalline cellulose (Avicel pH 112), magnesium stearate, opadry pink 03B84598.
Công dụng (Chỉ định)
- Ung thư vú di căn không đáp ứng với trị liệu bằng anthracyclin hoặc tái phát trong khi trị liệu hoặc sau trị liệu bằng anthracyclin. Kết hợp với docetaxel để gây hiệp đồng tác dụng: docetaxel làm tăng enzym có nhiều ở khối u chuyển capecitabin thành fluorouracil. Đơn trị liệu để điều trị ung thư vú khu trú tại chỗ hoặc đã di căn giai đoạn cuối ở bệnh nhân kháng cả paclitacel, cả phác đồ hóa trị liệu có anthracyclin hay ở bệnh nhân kháng paclitacel nhưng không dùng thêm được anthracyclin (như người đã dùng tới liều tích lũy 400 mg/m2 doxorubicin hoặc thuốc tương đương doxorubicin). Dùng một mình hoặc để hỗ trợ điều trị sau khi cắt bỏ khối u nguyên phát ung thư đại tràng giai đoạn III (giai đoạn C theo phân loại Duke) khi thấy điều trị bằng một fluoropyrimidin tốt hơn. Có thể dùng capecitabin đơn độc thay thế cho fluorouracil/leucovorin cho người bị cắt u hoàn toàn lần đầu.
- Capecitabin là thuốc được lựa chọn hàng 1 để điều trị ung thư đại – trực tràng di căn khi thấy đơn trị liệu bằng một fluoropyrimidin tốt hơn.
Cách dùng & Liều dùng
Cách dùng
- Capetero 500 cần nuốt nguyên viên cùng với nước trong vòng 30 phút sau khi ăn. Liều capecitabin được tính dựa trên diện tích bề mặt cơ thể.
Liều dùng
- Đơn trị (ung thư đại trực tràng di căn, điều trị hỗ trợ ung thư đại trực tràng, ung thư vú di căn)
- Liều khuyến cáo capecitabin là 1250 mg/m2 dùng đường uống ngày hai lần (vào buổi sáng và tối tương đương với tổng liều hàng ngày là 2500 mg/m2 theo chu kỳ 3 tuần — dùng thuốc trong vòng 2 tuần tiếp theo là 1 tuần nghỉ (xem bảng 1).
- Điều trị hỗ trợ trên những bệnh nhân bị ung thư đại trực trang Dukes’ C được khuyến cáo dùng trong 6 tháng [có nghĩa là liều thuốc uống capecitabin 1250 mg/m2 ngày hai lần trong 2 tuần tiếp theo sau là I tuần nghỉ trong 1 chụ kỳ 3 tuần, với tổng cộng 8 chu kỳ (24 tuần)].
| Liều 1250 mg/m2 (Ngày hai lần) | Số thuốc dùng tại mỗi liều (Sáng và tối ) | ||
| Diện tích bề mặt (m2) | Tổng liều hàng ngày*(mg) | 150mg | 500mg |
| ≤1.25 | 3000 | 0 | 3 |
| 1.26-1.37 | 3300 | 1 | 3 |
| 1.38-1.51 | 3600 | 2 | 3 |
| 1.52-1.65 | 4000 | 0 | 4 |
| 1.66-1.77 | 4300 | 1 | 4 |
| 1.78-1.91 | 4600 | 2 | 4 |
| 1.92-2.05 | 5000 | 0 | 5 |
| 2.06-2.17 | 5300 | 1 | 5 |
| ≥2.18 | 5600 | 2 | 5 |
*Tổng liều hàng ngày được chia lam hai lần để cho phép dùng liều buổi sáng và buổi tối có hàm lượng như nhau khi dùng kết hợp với docetaxel (ung thư vú di căn).
Khi kết hợp với docetaxel, liều khuyến cáo của capecitabin là 1250 mg/m2 ngày hai lần uống trong 2 tuần tiếp theo là 1 tuần nghị, kết hợp với liều docetaxel 75 mg/m2 tiêm tĩnh mạch trong vòng 1 giờ 3 tuần một lần. Pha chế thuốc theo như hướng dẫn trên nhãn thuốc đocetaxel trước khi dùng docetaxel cho các bệnh nhân đang sử dụng liều kết hợp capecitabin cong docetaxel. Bảng 1 mô tả tổng liều hàng ngày của capecitabin dựa trên diện tích bề mặt cơ thể và số viên thuốc cần dùng với mỗi liều.
Bảng 2. Chỉ tiêu phân mức độ ngộ độc hay xảy ra với capecitabin (trừ hội chứng tay – chân) theo viện ung thư quốc gia Canada (NCIC).
| Biểu hiện | Mức độ | Chỉ tiêu |
| Ỉa chảy | 1 | 2 – 3 lần/ngày, trước trị liệu. |
| 2 | 4 – 6 lần/ngày, trước trị liệu hoặc đi đại tiện ban đêm. | |
| 3 | 7 – 9 lần/ngày, trước trị liệu hoặc ỉa đùn và rối loạn hấp thu. | |
| 4 | > 10 lần/ngày, trước trị liệu, ỉa chảy phân sống có máu hoặc cần hỗ trợ theo đường tiêm. | |
| Buồn nôn | 1 | Vẫn có thể ăn được. |
| 2 | Ăn ít hẳn nhưng vẫn ăn thành bữa nhỏ. | |
| 3 | Hầu như không ăn được. | |
| Nôn | 1 | 1 lần/24 giờ. |
| 2 | 2- 5 lần/24 giờ. | |
| 3 | 6 – 10 lần/24 giờ. | |
| 4 | 10 lần/24 giờ, mất nước hoặc cần hỗ trợ theo đường tiêm. | |
| Đau bụng | 1 | Đau nhưng không cần điều trị. |
| 2 | Đau điều trị được bằng thuốc không phải opiat. | |
| 3 | Đau điều trị được bằng opiat. | |
| 4 | Đau không điều trị được. | |
| Hội chứng bàn tay – bàn chân | 1 | Tê, rối loạn/giảm cảm giác, ngứa, sưng không đau, đỏ bàn tay và/hoặc bàn chân gây khó chịu nhưng vẫn hoạt động bình thường được trong cuộc sống hàng ngày. |
| 2 | Da bàn tay và/ hoặc bàn chân đỏ, đau, sưng ảnh hưởng lên hoạt động sống bình thường hàng ngày. | |
| 3 | Da ướt, bị bong, loét, phồng rộp, đau nhiều ở bàn tay và/hoặc bàn chân, không làm được các việc bình thường trong cuộc sống hàng ngày. | |
| Giảm bạch cầu lympho | 1 | Số lượng bạch cầu lympho 1 500 – 1 999/mm3 |
| 2 | Số lượng bạch cầu lympho 1 000 – 1 499/mm3 | |
| 3 | Số lượng bạch cầu lympho 500 – 999/mm3 | |
| 4 | Số lượng bạch cầu lympho < 500/mm3 |
Bảng 3. Điều chỉnh liều do độc tính trong trị liệu với capecitabin và docetaxel.
| Mức độ theo NCIC | Mức 2 | Mức 3 | Mức 4 |
| Xuất hiện lần đầu : Trong quá trình điều trị |
Ngừng thuốc cho đến khi về mức 0 hoặc 1. | Ngừng thuốc cho đến khi về mức 0 hoặc 1. | Ngừng hẳn trị liệu hoặc |
| Trở lại trị liệu với 100% liều capecitabin lúc trước; không thay các liều đã thiếu. | Trở lại trị liệu với 100% liều capecitabin lúc trước; không thay các liều đã thiếu. | nếu bắt buộc phải tiếp tục trị liệu vì lợi ích cho bệnh nhân thì đợi cho đến khi về mức 0 -1 thì điều trị tiếp với liều bằng 50% liều đã dùng. | |
| Điều chỉnh liều cho chu kỳ tiếp theo | Nếu vẫn còn bị độc thì đợi đến khi trở về mức 0 -1. | Nếu vẫn còn bị độc thì đợi đến khi trở về mức 0 -1. | |
| Bắt đầu chu kỳ tiếp theo với liều bằng 100% liều capecitabin và docetaxel ban đầu. | Bắt đầu chu kỳ tiếp theo với liều capecitabin bằng 75% liều ban đầu và docetaxel 55 mg/m2. | ||
| Các biểu hiện bị độc như lần trước xuất hiện lần 2 : Trong quá trình điều trị |
Ngừng điều trị cho đến khi trở về mức 0 – 1. | Ngừng điều trị cho đến khi trở về mức 0 – 1. | Ngừng hẳn trị liệu. |
| Tiếp tục điều trị với liều capecitabin bằng 75% liều ban đầu; không thay thế các liều đã thiếu. | Tiếp tục điều trị với liều capecitabin bằng 50% liều ban đầu; không thay thế các liều đã thiếu. | ||
| Điều chỉnh liều cho đợt tiếp theo | Nếu vẫn còn bị độc thì đợi đến khi trở về mức 0 -1. | Nếu vẫn còn bị độc thì đợi đến khi trở về mức 0 -1. | |
| Bắt đầu chu kỳ mới với capecitabin bằng 75% liều ban đầu và liều docetaxel 55 mg/m2 | Bắt đầu chu kỳ mới với capecitabin bằng 50% liều ban đầu và ngừng dùng docetaxel. | ||
| Các biểu hiện bị độc như lần trước xuất hiện lần 3 : Trong quá trình điều trị |
Ngừng điều trị cho đến khi trở về mức 0 – 1. | Ngừng hẳn trị liệu. | |
| Tiếp tục điều trị với capecitabin bằng 50% liều ban đầu; không thay thế các liều đã thiếu. | |||
| Điều chỉnh liều cho đợt tiếp theo | Nếu còn bị độc, ngừng điều trị cho đến khi trở về mức 0 – 1. | ||
| Bắt đầu chu kỳ tiếp theo với capecitabin bằng 50% liều ban đầu và ngừng dùng docetaxel. | |||
| Các biểu hiện bị độc như lần trước xuất hiện lan 4 | Ngừng hẳn trị liệu. |
Chú ý: Bao giờ cũng phải thực hiện các biện pháp phòng ngừa độc tính của thuốc nếu có thể. Mọi thay đổi về liều lượng phải căn cứ vào mức bị độc nặng nhất trước đấy.
Bảng 4. Điều chỉnh liều do độc tính của capecitabin trong đơn trị liệu.
| Mức độ độc | Số lần bị độc | Trong quá trình dùng thuốc | Liều cho chu kỳ tiếp (% của liều ban đầu) |
| Mức 1 | Không có biểu hiện | Duy trì liều | Duy trì liều |
| Mức 2 | Lần 1 | Ngừng thuốc cho đến khi về mức 0 – 1. | |
| Lần 2 | Ngừng thuốc cho đến khi về mức 0 – 1. | ||
| Lần 3 | Ngừng thuốc cho đến khi về mức 0 – 1. | ||
| Lần 4 | Ngừng hẳn dùng thuốc. | 50% | |
| Mức 3 | Lần 1 | Ngừng thuốc cho đến khi về mức 0 – 1. | 75% |
| Lần 2 | Ngừng thuốc cho đến khi về mức 0 – 1. | ||
| Lần 3 | Ngừng hẳn dùng thuốc. | 50% | |
| Mức 4 | Lần 1 | Ngừng hẳn dùng thuốc hoặc nếu bắt buộc phải tiếp tục trị liệu vì lợi ích cho người bệnh thì đợi cho đến khi về mức 0 – 1 | 50% |
Chú ý: Mọi thay đổi về liều lượng phải căn cứ vào mức bị độc nặng nhất đã bị trước đấy.
Quá liều
- Các triệu chứng quá liều là buồn nôn, nôn, ỉa chảy, kích thích và chảy máu ống tiêu hóa, suy tủy. Bệnh nhân dùng 1 657 mg/m2/ngày (chia làm 2 lần) trong 6 tuần bị hội chứng bàn tay – bàn chân (lòng bàn tay, lòng bàn chân bị đỏ và giảm cảm giác), viêm niêm mạc và ỉa chảy.
- Không có thuốc đặc trị quá liều capecitabin. Xử trí quá liều chủ yếu là tạm ngừng dùng thuốc và tiến hành các biện pháp hỗ trợ thích hợp với biểu hiện ngộ độc. Lọc máu có thể lấy bớt 5’-deoxy-5- fluorouridin (DFUR) là chất chuyển hóa có phân tử lượng thấp của capecitabin. Từ tháng 5 năm 2009, FDA Hoa kỳ coi uridin triacetat (còn được gọi là vistonuridin), một tiền chất của uridin, là chất giải độc fluorouracil, liều dùng ở người lớn là 10 g, 6 giờ một lần, dùng 20 liều ngay sau khi bị ngộ độc 5 – FU. Tuy không có dữ liệu về tác dụng của uridin triacetat đối với ngộ độc capecitabin nhưng người ta cho rằng có thể có tác dụng.
Chống chỉ định
- Quá mẫn với capecitabin, fluorouracil hoặc với bất kỳ thành phần nào của thuốc.
- Bị thiếu hụt dihydropyrimidin dehydrogenase (DPD).
- Suy thận nặng (Cl < 30 ml/phút).
- Giảm bạch cầu, giảm bạch cầu trung tính hoặc giảm tiểu cầu nặng. Đang dùng sorivudin hoặc các thuốc tương tự như brivudin.
Tác dụng phụ
Rất thường gặp, ADR > 10/100:
- Tim – mạch: Phù TKTW: Mệt mỏi, sốt, đau.
- Da: Hội chứng tay – bàn chân (phụ thuộc liều), viêm da.
- Tiêu hóa: Ỉa chảy (phụ thuộc liều), buồn nôn, nôn, đau bụng, viêm miệng, giảm thèm ăn, chán ăn, táo bón.
- Huyết học: Giảm bạch cầu, thiếu máu, giảm bạch cầu trung tính, giảm tiểu cầu.
- Gan: Tăng bilirubin.
- Cơ – xương: Loạn cảm.
- Mắt: Kích ứng mắt.
- Hô hấp: Khó thở.
5/100 <ADR < 10/100:
- Tim – mạch: Tắc tĩnh mạch, đau ngực.
- TKTW: Nhức đầu, ngủ vùi, chóng mặt, mất ngủ, rối loạn tâm trạng, trầm cảm.
- Da: Bong móng, man đỏ, mất màu da, rụng tóc, ban đỏ.
- Nội tiết – chuyển hóa: Mất nước.
- Tiêu hóa: Rối loạn nhu động, khô miệng, khó tiêu, viêm đường tiêu hóa trên (ung thư đại trực tràng), chảy máu, viêm ruột non, rối loạn vị giác.
- Cơ – xương: Đau lưng, mỏi cơ, đau cơ, đau khớp, đau chi dưới, bệnh thần kinh.
- Mắt: Rối loạn thị giác, viêm kết mạc.
- Hô hấp: Ho.
- Khác: Nhiễm virus.
ADR < 5/100:
- Đau thắt ngực, cổ chướng, hen, rung nhĩ, nhịp tim chậm, viêm phế quản, viêm phổi – phế quản, co thắt phế quản, suy kiệt, ngừng tim, suy tim, bệnh cơ tim, tai biến mạch não, ứ mật, rối loạn đông máu, viêm đại tràng, tắc tĩnh mạch sâu, toát mồ hôi, viêm tá tràng, khó nuốt, loạn nhịp tim, thay đổi điện tâm đồ, bệnh về não, chảy máu cam, nhiễm nấm, loét dạ dày, viêm dạ dày – ruột, ỉa ra máu, ho ra máu, suy gan, xơ gan, viêm gan, hạ kali huyết, hạ magnesi huyết, tăng hoặc giảm huyết áp, quá mẫn, tăng triglycerid huyết, ban xuất huyết do hạ tiểu cầu, liệt ruột, nhiễm khuan, tắc ruột, viêm kết mạc – giác mạc, tắc hẹp ống lệ, giảm bạch cầu, mất ý thức, phù bạch huyết, viêm đa ổ chất trắng trong não, thiếu máu cơ tim, tắc ruột hoại tử, nhiễm candida ở miệng, tràn dịch màng ngoài tim, ban xuất huyết do giảm tiểu cầu, giảm các tế bào máu, phản ứng với ánh sáng, viêm phổi, ngứa, tắc động mạch phổi, hội chứng phản ứng da sau chiếu xạ, suy thận, suy hô hấp, tăng tiết mồ hôi, nhiễm khuấn huyết, loét da, nhịp tim nhanh, viêm tắc tĩnh mạch, giãn phì đại trực tràng, run đầu chi, ngoại tâm thu thất.
Thông báo cho Bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Hướng dẫn cách xử trí ADR:
- Đa số các ADR của capecitabin là hồi phục được và không cần phải ngừng thuốc. Nếu bị nặng thì phải giảm liều (xem bảng hướng dẫn điều chỉnh liều theo mức độ bị độc).
- Hay gặp rối loạn tiêu hóa khi dùng capecitabin, nhất là ở người cao tuổi. Có thể dùng các thuốc chống ỉa chảy thông thường như loperamid. Phải bồi phụ nước và điện giải nếu bị ỉa chảy nặng, mất nước. Dùng thuốc chống nôn nếu bị nôn.
- Phải kiểm tra huyết học trước khi dùng capecitabin. Nếu thấy bạch cầu trung tính giảm (< 1,5 x 109/lít) và/hoặc tiểu cầu giảm (< 100 x 109/lít) thì không được dùng capecitabin. Trong khi điều trị, nếu thấy bạch cầu trung tính giảm (< 1,0 x 109/lít) và/hoặc tiểu cầu giảm (< 75 x 109/lít) thì phải ngừng thuốc. Nếu có suy tủy: Có thể dùng các yếu tố kích thích tạo máu như filgrastim, sargramostim, truyền máu, truyền tiểu cầu… Bệnh nhân bị giảm bạch cầu trung tính nặng phải được cách ly để tránh nhiễm khuấn. Có thể phải truyền tủy cho người bị suy tủy nặng. Phải phòng giảm bạch cầu trung tính ở người có nguy cơ cao.
- Sốt có giảm bạch cầu trung tính: Phải cấy máu và dùng kháng sinh đường tĩnh mạch với người có nguy cơ cao, dùng theo đường uống với người có nguy cơ thấp.
- Giám sát chặt chẽ chức năng gan, nhất là ở người bị di căn ở gan vì có nguy cơ tăng bilirubin huyết nghiêm trọng.
- Phải thường xuyên theo dõi điện tâm đồ, nhất là ở người có tiền sử bệnh mạch vành để phòng nhồi máu cơ tim, thiếu máu cục bộ cơ tim, cơn đau thắt ngực, loạn nhịp, ngừng tim, đột tử.
- Viêm miệng: Rửa, xúc miệng bằng nước muối, bicarbonat. Nếu bị đau thì có thể dùng thuốc giảm đau tại chỗ; nếu đau nặng thì dùng thuốc giảm đau toàn thân. Chú ý dùng các thuốc có tác dụng tại chỗ để phòng nhiễm nấm và nhiễm khuấn miệng.
- Phải đi khám mắt nếu thấy thị lực giảm hoặc có các triệu chứng nặng ở mắt trong quá trình dùng capecitabin.
- Điều trị các biểu hiện ngộ độc khác tùy theo biểu hiện và mức độ biểu hiện.
Tương tác thuốc
- Không dùng đồng thời capecitabin với natalizumab, vắc xin sống. Capecitabin làm tăng nồng độ hoặc tác dụng của: Các cơ chất của CYP2C9, natalizumab, phenytoin, vắc xin sống, thuốc kháng vitamin K. Cần theo dõi các chỉ số về đông máu khi dùng đồng thời capecitabin và thuốc chống đông coumarin và có thể phải giảm liều thuốc chống đông. Cần kiểm soát nồng độ phenytoin ở người dùng đồng thời capecitabin và phenytoin.
- Capecitabin làm giảm nồng độ hoặc tác dụng của các vắc xin bất hoạt. Acid folinic làm tăng độc tính của capecitabin; phải giảm liều capecitabin (liều tối đa chỉ là 2 000 mg/m2 chứ không phải là 3 000 mg/m2) khi dùng đồng thời với acid folinic.
- Sovuridin và các chất cùng họ như brivudin làm tăng độc tính của fluoropyrimidin lên mức nguy hiểm. Chỉ bắt đầu dùng capecitabin ít nhất là 4 tuần sau khi đã ngừng dùng các thuốc này.
- Các thuốc kháng acid làm tăng nồng độ capecitabin và chất chuyển hóa 5’-deoxy-5-fluorocytidin (5’-DFCR). Uống các thuốc chống acid ít nhất là 2 giờ sau khi uống capecitabin.
- Alopurinol làm giảm tác dụng của 5-fluorouracil (5-FU). Tránh dùng đồng thời capecitabin và alopurinol.
- Liều capecitabin tối đa khi dùng đồng thời interferon alpha-2a (3 MUI/m2/ngày) là 2 000 mg/ngày chứ không phải là 3 000 mg/ ngày như khi được dùng một mình.
- Nếu kết hợp với xạ trị ung thư trực tràng, liều tối đa capecitabin là 2 000 mg/ngày, dùng theo phác đồ liên tục hoặc dùng hàng ngày từ thứ 2 đến thứ 6 trong đợt xạ trị kéo dài 6 tuần.
- Leucovorin, levoleucovorin, trastuzumab làm tăng nồng độ hoặc tác dụng của capecitabin.
Lưu ý (Thận trọng khi sử dụng)
- Capecitabin phải được dùng dưới sự giám sát của thầy thuốc chuyên khoa có kinh nghiệm trong điều trị bằng các thuốc chống ung thư.
- Phải thông báo cho bệnh nhân và gia đình biết về những tai biến có hại của capecitabin, đặc biệt là buồn nôn, nôn, ỉa chảy, hội chứng bàn tay – bàn chân. Ngoài ra, người bệnh cần biết cần phải điều chỉnh liều trong khi điều trị bằng capecitabin.
- Cần thông báo cho bác sĩ biết khi thấy: đại tiện ban đêm hoặc đại tiện tăng tới 4 – 6 lần một ngày hoặc nhiều hơn, buồn nôn kèm chán ăn, nôn 2 – 5 lần một ngày hoặc nhiều hơn, bàn chân bàn tay phù đỏ và đau, mồm đau, phù, sốt v.v… Phải ngừng thuốc và thông báo ngay cho thầy thuốc biết.
- Thận trọng khi dùng cho người cao tuổi (> 80 tuổi) vì tăng nguy cơ bị ADR nặng. Nếu dùng phải giám sát chặt chẽ.
- Phải thận trọng khi dùng cho người bị suy gan nhẹ tới vừa do bị di căn vào gan. Phải giám sát thường xuyên chức năng gan trong quá trình điều trị. Chưa có dữ liệu về thuốc ở người bị suy gan nặng. Phải thận trọng khi dùng capecitabin cho người bị suy thận vừa (Cl 30 – 50 ml/phút tính theo công thức Cockroft-Gault); phải giảm liều. Phải ngừng thuốc nếu thấy bị tác dụng phụ mức độ 2, 3, 4. Phải giám sát cấn thận khi dùng ở người bệnh có tiền sử bệnh mạch vành vì tác dụng có hại lên tim mạch đã xảy ra khi dùng pirymidin flour hóa.
- Nếu dùng capecitabin cho người bệnh đang dùng thuốc chống đông máu coumarin thì phải thường xuyên xác định thời gian prothrombin hoặc thời gian đông máu để điều chỉnh liều thuốc chống đông máu.
Phụ nữ mang thai và cho con bú
Phụ nữ mang thai:
- Chưa rõ capecitabin và các chất chuyển hóa có qua nhau thai hay không.
- Không dùng cho phụ nữ mang thai. Cần báo cho bệnh nhân trong tuổi sinh đẻ tránh mang thai trong thời gian điều trị bằng capecitabin. Nếu mang thai trong thời gian trị liệu phải giải thích cho bệnh nhân rõ các nguy cơ đối với thai.
Phụ nữ cho con bú:
- Không rõ capecitabin và các chất chuyển hóa có qua sữa hay không. Thực nghiệm trên chuột cho thấy capecitabin và các chất chuyển hóa có nhiều trong sữa chuột mẹ. Nếu dùng capecitabin thì phải ngừng cho con bú.
Người lái xe và vận hành máy móc
- Capecitabin có thể gây chóng mặt, mệt mỏi và buồn nôn; bệnh nhân dùng thuốc này cần thận trọng khi lái xe hoặc vận hành máy.
Dược động học (Tác động của cơ thể với thuốc)
Hấp thu
Sau khi uống, capecitabin được hấp thu nhanh và rộng khắp, sau đó được chuyển hóa mạnh thành chất chuyển hóa 5’-deoxy-5-fluorocytidin (S-DEFCR). Dùng cùng với thức ăn làm giảm tỷ lệ hấp thu capecitabin, nhưng chỉ ảnh hướng rất ít đến AUC của 5′-DFUR và chất chuyển hóa tiếp theo
của nó là 5-FU. Với liều 1250mg/m” vào ngày thứ 14 dùng sau khi ăn, nồng độ đỉnh huyết tương (Cmax tính bằng pg/ml) cho capecitabin, 5’-DFCR, 5’-DFUR, 5-FU va FBAL tương ứng là 4,47; 3,05; 12,1; 0,95 và 5,46. Thời gian để đạt tới nồng độ đỉnh huyết tương (Tmax tính bằng giờ) tương ứng là
1,50; 2,00; 2,00; 2,00 và 3,34. Giá trị AUC tính bằng μgh/ml tương ứng là 7,75; 7,24; 24,6; 2,03 và 36,3.
Phân bố
Gắn kết với protein: Các nghiên cứu huyết tương in-vitro đã chứng minh rằng tỷ lệ gắn kết protein của capecitabin, 5’-DFCR, 5’-DFUR va 5-FU lần lượt là 54%, 10%, 62% và 10%, chủ yếu gắn với albumin.
Chuyên hóa
Capecitabin chuyển hóa đầu tiên bởi men carboxylesterase ở gan thành 5’-DFCR, chất này sau đó được chuyển thành 5’-DFUR bởi cytidin deaminase, là men tập trung chủ yếu ở gan và mô khối u. Sự hình thành 5-FU xảy ra chủ yếu tại vị trí khối u bởi yếu tố tạo mạch có liên quan đến khối u là dThdPase, do đó làm giảm tối đa mức độ của mô lành với 5-FU trong cơ thể.
AUC huyết tương của 5-FU thấp hơn 6 đến 22 lần nồng độ sau khi truyền tĩnh mạch nhanh 5-FU (liều 600mg/m2). Các chất chuyển hóa của capecitabin chỉ trở lên có độc tính sau khi chuyển thành 5-FU và các chất đồng hóa của 5-FU. 5-FU được chuyên hóa tiếp thành các chất chuyển hóa không có hoạt tinh dihydro-5-fluoruracil (FUH2), 5-fluoro-ureidopropionic acid (FUPA) và a-fluoro-B-alanin (FBAL) thông qua dihydro-pyrimidin dekydrogenase (DPD) chất này mang tính chuyển hóa chậm.
Thải trừ
Thời gian bán thải (tra tính bằng giờ) của capecitabin, 5′-DFCR, 5°-DFUR, 5-FU và FBAL tương ứng là 0,85; 1,11; 0,66; 0,76 và 3,23. Dược động học của capecitabin được đánh giá trên khoảng liều là 502-3514 mg/m?/ngày. Các thông số của capecitabin,5’-DFCR va 5’-DFUR được đo vào ngày đầu tiên và ngày 14 là như nhau. AUC của 5-FU là 30%-35% cao hơn vào ngày 14, nhưng không tăng lên sau đó (ngày 22). Tại liều điều trị, dược động học của capecitabin và các chất chuyển hóa của nó tỉ lệ với liều, trừ 5-FU. Sau khi uống, các chất chuyển hóa của capecitabin được tìm thấy chủ yếu trong nước tiểu. 95,5% liều capecitabin được dùng tìm thấy trong nước tiêu. Bài tiết trong phân rất ít (2,65). Chất chuyển hóa chính có trong nước tiêu là FBAL, chiếm 57% liều dùng. Khoảng 3% liều dùng được đào thải trong nước tiêu dưới dạng thuốc không đổi.
Dược lực học (Tác động của thuốc lên cơ thể)
Capecitabin là đẫn xuất fluoropyrimidin carbamat được điều chế để dùng đường uống, là thuốc độc tế bào được hoạt hóa bởi khối u và chọn lọc trên khối u.
Capecitabin không phải là chất độc tế bảo in vitro.Tuy nhiên, in vivo, thuốc biến đổi liên tiếp thành chất gốc độc tế bào là 5-fluorouracïl (5-FU), chất này sẽ được chuyển hóa tiếp.
Thymidinphosphorylase (ThyPase), enzym liên quan đến sự biến đổi cuối cùng thành 5-FU, được tìm thấy mô bị ung thư, và ở cả các mô lành, nhưng thường với số lượng ít hơn. Sự biến đổi sinh học tuần tự của men từ capecitabin thành 5-FU dẫn tới nồng độ của 5-FU cao hơn trong mô khối u. Sau
khi cho bệnh nhân ung thư đại trực tràng (N=8) uống capecitabin, tỉ số nồng độ của 5EU ở khối u đại trực tràng so với cdc mé gan kề là 3,2 (dao động từ 0,9 đến 8,0). Tỷ số nồng độ khối u so với huyết tương là 21,4 (dao động từ 3,9 đến 59,9) trong khi tỷ số ở các mô khỏe mạnh SO với huyết tương là
8,9 (dao động từ 3,0 đến 25,8). Hoạt tính của thymidin phosphorylase cao hơn gấp 4 lầnở khối u đại trực tràng so với mô bình thường bên cạnh.
Một vài khối u ở người, như ung thư vú, dạ dày, đại trực tràng, cổ tử cung và buồng trứng có nồng độ thymidin phosphorylase cao hơn (có khả năng chuyển 5′-DFUR [5′-deoxy-5-fluorouridin] thành 5-FU)so với các mô bình thường tương ứng
Các tế bào bình thường và các tế bào khối u chuyển hóa 5-FU thành 5-fluoro-2-deoxyuridin monophosphat (FdUMP) va 5-fluorouridin triphosphat (FUTP). Những chất chuyển hóa này sẽ làm tổn thương tế bào bằng hai cơ chế. Đầu tiên, FdUMP và đồng yêu tố folat N methylenetetra
hydrofolat gắn với thymidylat synthase (TS) tao nên một phức hợp gồm 3 yếu tố đồng hóa trị. Sự gắn kết này sẽ ức chế sự hình thành thymidylat synthase (TS) tạo nên Regpie hợp gồm 3 yếu tố đồng hóa trị. Sự gắn kết này sẽ ức chế sự hình thành thymidylat từ uracil. Thymidylat là một tiền chất cần thiết của thymidin triphosphai, một chất cần thiết cho sự tổng hợp DNA vì vậy sự thiếu hụt hợp chất này có thể ức chế sự phân chia tế bào. Thứ hai, các men sao chép nhân có thể kết hợp một cách nhầm lẫn FUTP thay vì uridin triphosphat (UTP) trong quá trình tổng hợp RNA. Lỗi chuyển hóa này có thể ảnh hưởng tới sự tổng hợp RNA và protein.
Bảo quản
- Bảo quản thuốc ở nhiệt độ <30°C, tránh ẩm.
- Để thuốc xa tầm tay trẻ em.
Hạn dùng
24 tháng kê từ ngày sản xuất
Bài viết được cập nhật lần cuối 14 Tháng 4, 2025
Thông tin thương hiệu

Hetero
Giới thiệu về Hetero
Hetero là một trong những tập đoàn dược phẩm hàng đầu Ấn Độ, chuyên sản xuất và cung cấp các sản phẩm chăm sóc sức khỏe chất lượng cao trên toàn cầu. Với hơn 30 năm kinh nghiệm trong ngành, Hetero đã xây dựng được vị thế vững chắc trong lĩnh vực dược phẩm, đặc biệt là sản xuất thuốc generic và dược phẩm sinh học. Công ty sở hữu hệ thống sản xuất đạt tiêu chuẩn WHO-GMP, USFDA và các tiêu chuẩn quốc tế khác, đảm bảo chất lượng và an toàn cho người sử dụng.
Lịch sử hình thành và phát triển
- 1993: Hetero được thành lập bởi Tiến sĩ BPS Reddy, với mục tiêu sản xuất thuốc generic phục vụ nhu cầu y tế.
- 2000: Mở rộng danh mục sản phẩm, tập trung vào thuốc kháng virus và điều trị HIV/AIDS.
- 2012: Phát triển mạnh mẽ trong lĩnh vực dược phẩm sinh học, nghiên cứu và sản xuất các loại thuốc điều trị ung thư.
- 2018: Đạt được nhiều chứng nhận quốc tế, mở rộng thị trường sang hơn 100 quốc gia.
- 2023: Tiếp tục đẩy mạnh nghiên cứu công nghệ sinh học, phát triển thuốc điều trị các bệnh mãn tính.
Thế mạnh của Hetero
Sản phẩm và công nghệ tiên tiến
- Thuốc generic: Cung cấp nhiều loại thuốc chất lượng với giá thành hợp lý.
- Thuốc kháng virus: Hàng đầu trong sản xuất thuốc điều trị HIV, viêm gan C.
- Dược phẩm sinh học: Nghiên cứu và phát triển các dòng thuốc điều trị ung thư, tiểu đường.
- API (Active Pharmaceutical Ingredients): Đứng đầu trong sản xuất nguyên liệu dược, cung cấp cho nhiều công ty dược phẩm trên thế giới.
Cam kết phát triển bền vững
- Chứng nhận quốc tế: WHO-GMP, USFDA, EMA, TGA và nhiều chứng nhận khác.
- Sản xuất xanh: Ứng dụng công nghệ thân thiện với môi trường, giảm thiểu tác động tiêu cực.
- Trách nhiệm xã hội: Thực hiện nhiều chương trình hỗ trợ y tế cộng đồng, cung cấp thuốc giá rẻ cho các nước đang phát triển.
Thành tựu nổi bật
- Hơn 30 năm phát triển, trở thành một trong những công ty dược phẩm hàng đầu Ấn Độ.
- Mạng lưới phân phối rộng khắp, xuất khẩu sản phẩm đến hơn 100 quốc gia.
- Nghiên cứu và phát triển mạnh mẽ, tập trung vào công nghệ sinh học và thuốc điều trị bệnh mãn tính.
Thông tin liên hệ
Trụ sở chính:
- Địa chỉ: Hetero Corporate, 7-2-A2, Industrial Estate, Sanath Nagar, Hyderabad – 500018, Telangana, Ấn Độ
- Điện thoại: +91-40-23704923
- Website: www.hetero.com
Văn phòng tại Việt Nam:
- Địa chỉ: Tầng 8, Số 37, đường Ký Con, phường Nguyễn Thái Bình, quận 1, thành phố Hồ Chí Minh.
- Điện thoại: Thông tin không có sẵn.
- Email: Thông tin không có sẵn.
Hetero cam kết tiếp tục đổi mới, nâng cao chất lượng sản phẩm và đóng góp vào sự phát triển của ngành dược phẩm toàn cầu.

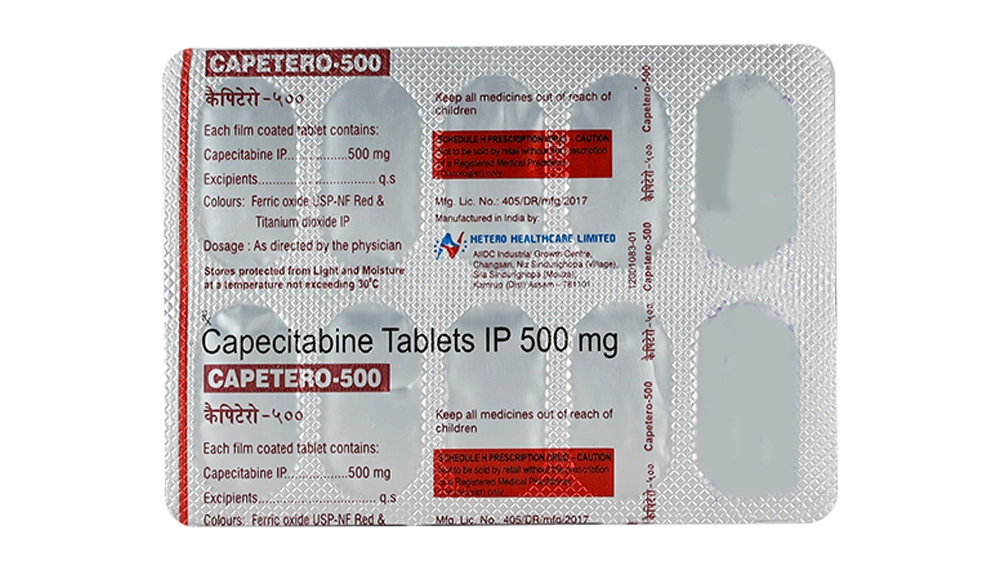











 - Thư viện thông tin cho dược sĩ và người dùng
- Thư viện thông tin cho dược sĩ và người dùng